Азотная кислота. Свойства и применение. История открытия. Азотная кислота по объему производства занимает среди других кислот второе место после серной кислоты. Все возрастающий объем производства HNO 3 объясняется огромным значением азотной кислоты и ее солей для народного хозяйства.
- Производство Азотной Кислоты В Промышленности Презентация
- Производство Азотной Кислоты В Промышленности
- Получение Азотной Кислоты В Промышленности Уравнение
- Получение Азотной Кислоты В Промышленности
Азотная кислота является одним из исходных продуктов для получения большинства азотсодержащих веществ. До 70-80% ее количества расходуется на получение минеральных удобрений. Также азотная кислота применяется: - при производстве серной кислоты нитрозным способом; - при получении почти всех видов взрывчатых веществ; - нитратов и ряда других технических солей; - в промышленности органического синтеза; - в ракетной технике; - как окислитель в различных процессах и во многих отраслях народного хозяйства.
Учитывая нужды различных потребителей, промышленностью вырабатывается азотная кислота девяти сортов с концентрацией от 45 до 99%. В небольших объемах выпускается реактивная и азотная кислота особой чистоты. В производстве взрывчатых веществ нитрованием органических продуктов применяют концентрированную азотную кислоту. Для получения удобрений потребляется, как правило, разбавленная азотная кислота. Основным сырьем для производства неконцентрированной азотной кислоты в настоящее время являются аммиак, воздух и вода. Вспомогательными материальными и энергетическими ресурсами являются катализаторы окисления аммиака и очистки выхлопных газов, природный газ, пар и электроэнергия.
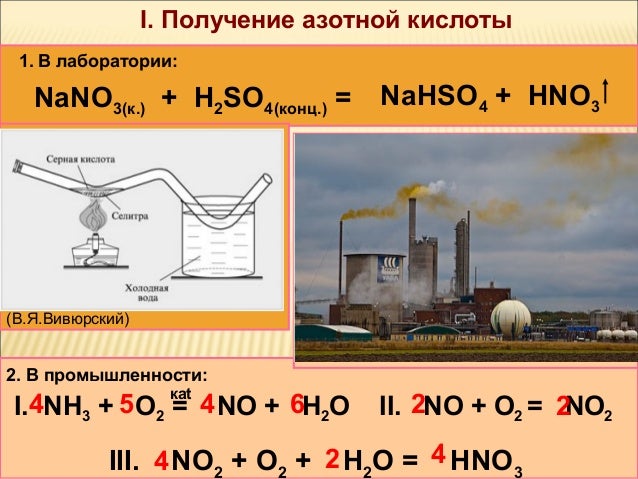
Азотная кислота и главным образом ее природная соль - натриевая селитра известны с давних времен. Арабский ученый Гебер описал способ приготовления “крепкой водки” (так называлась тогда азотная кислота) путем перегонки селитры с квасцами. В России первые прописи по производству азотной кислоты из селитры были составлены М.В. До начала XX века природная селитра была единственным источником получения азотной кислоты. Этот процесс основан на следующей реакции: NaNO 3 + H 2SO 4 = HNO 3 + NaHSO 4 Усовершенствованный вариант этого метода получения азотной кислоты состоял в том, что разложение селитры серной кислотой производилось в вакууме. При этом температура разложения селитры снижалась до 80-160 0С; продолжительность отгонки кислоты сокращалась до 6 часов и достигался выход азотной кислоты близкий к теоретическому. Такой способ получения азотной кислоты, целиком зависящий от импорта чилийской селитры, впоследствии был оставлен.
В начале XX века была решена исключительно важная проблема связывания атмосферного азота, что дало человечеству новый неисчерпаемый источник сырья для производства азотсодержащих соединений. Еще в 1781 г. Кэвендиш в результате электрического разряда в воздухе получил окислы азота. Каразин внес предложение о “низведении электричества с верхних слоев атмосферы для производства селитры”. Первый патент на способ получения азотной кислоты при помощи электрического разряда в воздухе и превращения окислов азота в нитриты и в нитраты был получен в 1859 г. Было положено начало фиксации азота воздуха в пламени электрической дуги (дуговой метод).
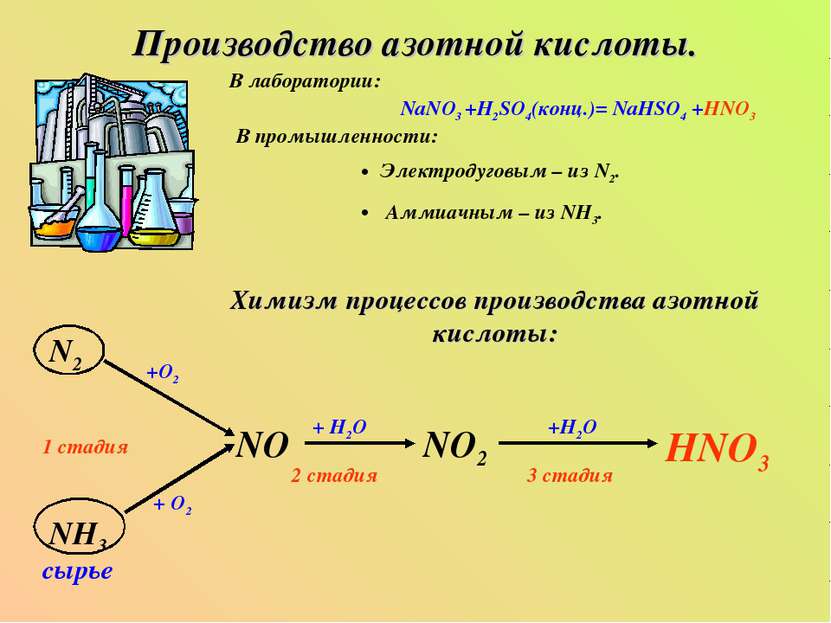
Сырье для производства азотной кислоты. В производстве азотной. Азотная промышленность является одной из быстро развивающихся отраслей. Азотная кислота является одним из исходных продуктов для получения большинства азотосодержащих веществ и принадлежит к числу важнейших кислот. По масштабу производства азотная кислота занимает. 9.1.3 Сырье для производства азотной кислоты. В настоящее время в промышленных масштабах азотная кислота производится исключительно из аммиака. Поэтому структура сырья азотнокислотного производства совпадает со структурой сырья для производства аммиака (рис.9.2). Рисунок 9.2 – Сырье.
В США сооружен завод по фиксации атмосферного азота с помощью электрической дуги, возникающей при пропускании между электродами тока силой 0,75 ампер и напряжением 8000 вольт. Из-за несовершенства конструкции печи и большого расхода электроэнергии завод был закрыт в 1904 г.
Производство азотной кислоты дуговым методом интересно тем, что в нем использовали дешевое исходное сырье - воздух. Аппаратурное оформление процесса было довольно несложным. Однако для его осуществления требовалось огромное количество электроэнергии, достигающее 70000 квт´ч на 1 т N 2 (это соответствует 64 т условного топлива) В настоящее время промышленное производство азотной кислоты осуществляется на основе контактного окисления синтетического аммиака. Процесс складывается из двух основных стадий: получение окиси азота и переработка ее в азотную кислоту.
Тема №8: Производство азотной кислоты. Назовите области применения азотной кислоты. Области применения азотной кислоты:. Производство азотных удобрений;.
Производство взрывчатых веществ;. Производство красящих веществ;. Лекарственные препараты;. Синтез различных химических веществ;. Полимерные материалы (пластмассы). Что является сырьем для производства азотной кислоты и какие требования к нему предъявляются?
Сырьем для получения продуктов в азотной промышленности являются атмосферный воздух и различные виды водород-содержащего сырья (уголь, сланцы, газ и др.). Одной из составных частей воздуха является азот, который используется в процессах получения аммиака, цианамида кальция и других продуктов азотной технологии. Поскольку ресурсы атмосферного азота огромны, то сырьевая база азотной промышленности в основном определяется вторым видом сырья – углеводородами, применяемым для получения водорода или водород-содержащего газа.
Сырьем для получения азотной кислоты служат аммиак, воздух и вода. Синтетический аммиак в большей или меньшей степени загрязнен примесями. Такими примесями являются катализаторная пыль, смазочное масло (при сжатии поршневым компрессором). Для получения чистого газообразного аммиака служат испарительные станции и дистилляционные отделения жидкого аммиака. Атмосферный воздух, применяемый в производстве азотной кислоты, забирается на территории завода или вблизи его. Этот воздух загрязнен газообразными примесями и пылью.
Поэтому он подвергается тщательной очистке во избежание отравления катализатора окисления аммиака. Очистка воздуха осуществляется, как правило, в скруббере, а затем в двухступенчатом фильтре. Составьте химическую и функциональную схемы получения разбавленной азотной кислоты. Процесс производства разбавленной азотной кислоты складывается из трех стадий: конверсия аммиака с целью получения оксида азота 4NH 3+ 5O 2= 4NO+ 6H 2O окисление оксида азота до диоксида 2NO+O 22NO абсорбция оксидов азота водой 4NO2 +O2 + 2H 2O= 4HNO 3 Физико-химические основы процесса конверсии аммиака Окисление аммиака кислородом воздухом без катализатора возможно только до N2.
На катализаторе между аммиаком и кислородом протекают следующие реакции: 4NH3 + 5O 2 = 4NO + 6H 2O; ΔH = – 946кДж 4NH3 + 3O 2 = 2N2 + 6H 2O; ΔH = – 1328кДж Реакции окисления аммиака сопровождаются значительной убылью свободной энергии, протекают с большой скоростью, практически необратимо. Теплоты, выделяющейся во время реакции, вполне достаточно, чтобы процесс шел автотермично.
Каталитическое окисление аммиака – многостадийный гетерогенно-каталитический процесс, протекающий во внешнедиффузионной области и лимитируемый диффузией аммиака к поверхности катализатора. Катализаторы, применяемые для окисления аммиака, должны обладать избирательными свойствами, т.е. Ускорять только одну реакцию.
Наиболее активным и селективным катализатором является платина. Она также имеет низкую температуру зажигания 200 °С, хорошую пластичность, тягучесть. Но ее недостаток – это быстрое разрушение при высоких температурах при воздействии больших скоростных потоков реагентов и катализаторных ядов.
Это приводит к потерям дорогостоящего катализатора и выхода оксида азота, что явилось причиной использования сплавов платины с другими металлами. Наибольшее распространение получили следующие катализаторы (ГОСТ 3193-59): Pt+ 4%Pd+ 3,5%Rh– для работы при атмосферном давлении иPt+ 7,5%Rh– при повышенном давлении. Катализаторы изготавливают в виде сеток. Такая форма удобна в эксплуатации и связана с минимальными затратами металла. Катализаторы весьма чувствительны к ряду примесей, содержащихся в аммиаке и воздухе, особенно к соединениям фтора и серы. Примеси заметно снижают селективность катализатора. Для поддержания стабильной степени конверсии необходима тщательная очистка АВС1 и от механических примесей, особенно от оксидов железа и пыли железного катализатора синтеза аммиака.
Срок службы до 14 месяцев при атмосферном давлении и до 9 при повышенном. Температура оказывает наибольшее влияние на выход оксида азота (II).
При повышении температуры выходNOрастет, причем существует оптимальная температура (для чистой платины 900 – 920 єС), при которой достигается максимальный выход. Большое значение имеет температура зажигания катализатора, которая зависит в основном от его состава. На платине реакция начинается при 195 єС. Выход достигает значения 96% на чистой платине и 99% на сплавах.
Проведение процесса при высоких температурах помимо увеличения выхода монооксида азота имеет и другие преимущества: растет скорость реакции окисления аммиака и уменьшается время контактирования. Но при повышении температуры увеличиваются потери дорогостоящей платины, т.е. Ухудшаются экономические показатели процесса. С ростом давления наблюдается снижение выхода оксида азота (II). Вместе с тем использование высокого давления позволяет повысить производительность агрегата, уменьшить размеры аппаратов. Процесс осуществляется под давлением 0,41 – 0,73 МПа. Основным условием получения высоких выходовNOпод давлением являются повышение температуры и времени контактирования (увеличение числа сеток).
При стехиометрическом соотношении кислорода и аммиака O2:NH3 = 1,25 даже при атмосферном давлении выход оксида азота не превышает 60 – 80%. Кроме того, пришлось бы работать в области взрывоопасных концентраций. При увеличении соотношенияO2:Nдо 1,7 что соответствует содержанию аммиака в смеси 11,5%, выходNOвозрастает.д.ля получения высокого выходаNOнеобходим 30% -ный избыток кислорода сверх стехиометрического. Это связано с тем, что поверхность платинового катализатора должна постоянно быть покрыта кислородом, иначе уже при 500 єС аммиак начинает разлагаться на азот и кислород.
Какая реакция имеет небольшую термодинамическую вероятность исходя из анализа термодинамических характеристик реакции окисления аммиака?. Обоснуйте выбор температуры, давления, концентрации аммиака в аммиачно-воздушной смеси, обеспечивающих оптимальный выход оксида азота на стадии контактного окисления аммиака. Что такое время контактирования, от чего оно зависит?
Время контактирования, необходимое для достижения оптимальной ( но не обязательно максимальной) степени превращения, зависит в основном от концентрации катализатора и рабочей температуры. Время контактирования может задаваться или варьироваться в широких пределах путем регулирования объемной скорости подаваемых реагентов или изменением объема смесительной камеры. Время контактирования зависит от природы катализатора. Время контактирования зависит от температуры.
Время контактирования в псевдоожиженном слое зависит от соотношения диаметра и высоты слоя, скорости газа, крупности частиц, интенсивности перемешивания газа и твердых частиц в слое и других факторов. Какие катализаторы применяют для окисления аммиака? Какие примеси газовой смеси являются ядами катализатора?
С чем связаны потери катализатора и какие пути снижения этих потерь можно предусмотреть? Окись азота может образовываться только на поверхности катализатора, и в этом состоит его существенное значение для окисления аммиака, тогда как азот образуется в объёме, вне поверхности катализатора. Наиболее селективным и активным в данной реакции является платиноидный катализатор, представляющий собой сплав платины с палладием и родием.
Чистая платина при высоких температурах быстро разрушается. Примесь в платине незначительного количества железа снижает активность катализатора. Сплав платины с родием делает катализатор в процессе окисления аммиака до оксида NOактивным и стойким к высоким температурам. Степень окисления аммиака при атмосферном давлении и температуре 1093-1113 К на платинородиевом катализаторе достигается 97,5-98% и сохраняется в течение 10-12 мес; в системах, работающих под давлением 700-800 кПа, окисление достигается при температуре 1173-1193 К и выходNOснижается до 95-96%. Срок службы катализатора под повышенным давлением 45-90 дней. Учитывая высокую стоимость и дефицитность материалов платиновой группы, проводятся исследования синтеза неплатиновых катализаторов.
Государственным институтом азотной промышленности разработан двухступенчатый катализатор, в котором первая ступень окисления аммиака на одной платиноидной сетке, вторая ступень - на слое неплатинового катализатора толщиной 40-50 мм. Хорошим неплатиновым катализатором является железохромовый катализатор в виде таблеток диаметром 5 мм с прочностью на сжатие до 0,05 гПа. Прочность этого катализатора увеличивается в процессе его эксплуатации и после 6 мес. Работы достигает 0,12 гПа. Осаждение некоторого количества платины на таблетках неплатинового катализатора в ходе процесса повышает его активность. На двухступенчатом катализаторе окисляется 97% аммиака, причем на платиновой сетке - 85-90%.
Срок службы двухступенчатого катализатора 3-5 лет, и регенерация его невозможна. Применение двухступенчатого катализатора даёт возможность сократить одновременные вложения платины в три раза, однако потери её при этом сокращаются всего на 10-20%. Платиновый катализатор очень чувствителен к примесям, обычно присутствующим в воздухе и аммиаке. Наиболее сильное влияние оказывает фосфористый водород. При содержании его в аммиачно-воздушной смеси 2 - 10 - 5% степень окисления аммиака снижается на 80%, при этом отравление катализатора является необратимым.
Вредное действие оказывают также соединения серы и некоторые другие вещества; при содержании в газовой смеси 1% сероводорода активность платины снижается на несколько процентов. Платиновые катализаторы весьма чувствительны к некоторым1 примесям, могущим присутствовать в обжиговых газах. Под дей - ствием этих примесей-ядов - катализатор теряет активность - отравляется. При этом первые порции яда часто вызывают зна - чительно большее снижение активности платины, чем последующие. Как устроены контактные аппараты для окисления аммиака?
В этих системах нитрозные газы, полученные контактным окислением аммиака, направляются в поглотительные башни сернокислотной системы. Получают из ннтрозных газов, образующихся при контактном окислении аммиака, в качестве побочных продуктов в производстве азотной кислоты или нитратов. Применение повышенного давления при получении азотной кислоты методом контактного окисления аммиака было вызвано необходимостью увеличить скорости окисления окиси азота и образования азотной кислоты.
В этом отношении преимущества высокого давления совершенно бесспорны. Применение повышенного давления в производстве азотной кислоты методом контактного окисления аммиака было вызвано главным образом необходимостью увеличения скорости окисления окиси азота и образования азотной кислоты.
В этой части преимущества высокого давления совершенно бесспорны. Запретно-разрешающее блокировочное устройство используется, например, при контактном окислении аммиака в производстве азотной кислоты. В случае прекращения подачи воздуха, концентрация аммиака может увеличиться до взрывоопасных пределов 15 - 28% ( об.) и при контакте с раскаленным ( до 800 - 900 С) катализатором произойдет воспламенение аммиачно-воздушной смеси. Поэтому подачу аммиака блокируют с подачей воздуха, используя для этого электромагнитный отсекатель.
В противоположность системам, работающим под атмосферным давлением, здесь контактное окисление аммиака и поглощение нитрозных газов проводятся под повышенным давлением. Кюльман первый правильно оценил значение метода получения азотной кислоты контактным окислением аммиака и роль катализатора в осуществлении этого процесса. Существуют установки для получения разбавленной азотной кислоты, в которых контактное окисление аммиака и поглощение окислов азота из нитрозных газов происходит при повышенном давлении. Установки работают или на обычном атмосферном воздухе, или на воздухе, обогащенном ( до 26%) кислородом. Андреев совершенно самостоятельно разработал технологию получения азотной кислоты контактным окислением аммиака. В России был освоен в промышленном масштабе способ контактного окисления аммиака в окислы азота, который нашел широкое распространение. С развитием последнего метода дуговой метод связывания азота воздуха был оставлен в связи с большим расходом электроэнергии.
Жидкие окислы азота получают из нитрозных газов, представляющих собой продукт контактного окисления аммиака воздухом. Концентрированная азотная кислота применяется в производстве взрывчатых веществ, нитратов целлюлозы, нитроглицерина, ракетного топлива и других веществ.
В заключение следует сказать, что основные направления в усовершенствовании собственно процесса контактного окисления аммиака связаны с решением вопросов достижения высоких выходов окиси азота, повышения производительности контактных аппаратов, получения окислов азота высокой концентрации, снижения потерь дорогостоящего платинового катализатора, уменьшения основных расходов и стоимости строительства азотнокислотных предприятий. Каков механизм образования разбавленной азотной кислоты на стадии абсорбции нитрозных газов? Какими технологическими параметрами определяется степень поглощения диоксида азота? Воздух поступает в систему через заборную трубу, устанавливаемую в местности с чистым воздухом, как правило, вдали от территории завода. Для очистки воздуха от механических и химических примесей устанавливается ситчатый пенный промыватель 1 и картонный фильтр 2. Аммиак, поступающий со склада, также очищается от примесей в картонном фильтре 3. Транспортировка газов через систему осуществляется при помощи аммиачно-воздушного вентилятора 4.
Далее газовая смесь проходит в контактный аппарат 5. Горячие нитрозные газы с температурой около 800°С поступают в котел-утилизатор 6, где вырабатывается пар, а температура газов снижается до 250°С. Затем газы охлаждаются водой примерно до 30°С в кожухотрубных холодильниках 7 (на схеме показан один). При этом происходит конденсация водяных паров и в небольшой степени окисление оксида азота до диоксида, который, частично поглощаясь конденсатом, дает разбавленную азотную кислоту. После этого нитрозные газы газодувкой 8 подаются в абсорбционные башни 9, заполненные насадкой из кислотоупорных колец.
Последняя по ходу газа башня орошается водой, а из первой башни отбирается продукционная кислота. Циркуляция кислоты в системе осуществляется насосами 10. Для охлаждения разогретой кислоты, вытекающей из башен, служат водяные холодильники 11. В поглотительных башнях перерабатывается примерно 92% оксидов азота. Кроме того, в процессе абсорбции выделяется NО. Поэтому за абсорбционными башнями устанавливается окислительная башня 12, где происходит частичное окислениеNО до диоксида азота.
Далее газы поступают в башню 13 (обычно две) для поглощенияNО иNО2 раствором соды с образованием так называемых нитрит-нитратных щелоков. Вместо раствора соды можно применять раствор едкого натра или Са(ОН)2.Обезвреженные таким образом выхлопные газы выбрасываются в атмосферу. Каким требованиям должна удовлетворять абсорбционная аппаратура в производстве слабой азотной кислоты? Концентрированная серная кислота, образуя при этом гидраты, кипит при более высокой температуре, чем 100%-ная HNO3.
Часть потока разбавленной азотной кислоты из емкости нагревается в испарителе и подается на 10-ю тарелку концентрационной колонны, другая часть без подогрева поступает на вышележащую тарелку колонны. Серная кислота из емкости поступает в верхнюю часть колонны выше ввода холодного потока азотной кислоты.
В нижнюю часть колонны вводится острый пар (на схеме не показан), при нагревании которым из тройной смеси начинает испаряться азотная кислота. Пары азотной кислоты при температуре 70-85°С, поднимаясь вверх, выходят из колонны, конденсируются при температуре около 30°С в холодильнике конденсаторе с образованием 98-99%-ной азотной кислоты. В холодильнике-конденсаторе 6 пары азотной кислоты имеют примеси оксидов азота и воды. При конденсации азотная кислота частично поглощает оксиды азота, направляется на две верхние тарелки и проходит их последовательно, причем оксиды выдуваются из раствора парами азотной кислоты, поступающими в холодильник-конденсатор. Концентрированная азотная кислота охлаждается в холодильнике 5 и поступает в хранилище. Отработанная серная кислота направляется на концентрирование. Недостатком этого метода концентрирования является высокое содержание паров и тумана серной кислоты в выхлопных газах после электрофильтров (0,3-0,8 г/м3 газа), что требует их тщательной и дорогостоящей очистки перед выбросом в атмосферу.
С какой целью продукционную азотную кислоту продувают воздухом? Куда направляют отходящие газы со стадии продувки?.
Какие методы могут быть использованы для очистки хвостовых газов производства азотной кислоты? Сравните их достоинства и недостатки. В производстве азотной кислоты комбинированным методом в качестве отходов производства образуются 'хвостовые' газы, очищенные в реакторах каталитической очистки, вентиляционные выбросы вредных веществ, сточные воды. После абсорбционных колонн образуются 'хвостовые' газы с содержанием NO+NO2 не более 0,5%. (при получении неконцентрированной азотной кислоты) и не более 0,2%. (при получении нитроолеума), которые направляются на установку каталитического разложения оксидов азота до элементарного азота газообразным аммиаком на алюмованадиевом катализаторе АВК-10 (АОК-78-55) и железохромовом катализаторе СТК-1 при температуре 320оС и давлении не более 0,35 МПа. Очищенные 'хвостовые' газы после реакторов каталитической очистки с температурой не более 320оС, направляются в турбодетандеры для рекуперации энергии и далее в выхлопную трубу.
Производство Азотной Кислоты В Промышленности Презентация
Отдувочные газы из хранилищ, продувочных колонок и отделения 2 поступают на всас турбокомпрессора. Кроме того, в цехе имеются вентиляционные выбросы оксидов азота и аммиака из контактного отделения, машинного отделения, насосной продукционной кислоты. Сточные воды из отделения неконцентрированной азотной кислоты выводятся по: - хозфекальной канализации; - промливневой канализации; - канализации химзагрязненных стоков. В чем состоит сущность концентрирования азотной кислоты с помощью водоотнимающих средств? Концентрирование азотной кислоты с помощью водоотнимающих веществ.
Получить концентрированную азотную кислоту перегонкой разбавленной кислоты невозможно. При кипении и перегонке разбавленной азотной кислоты ее можно упарить лишь до содержания 68,4% HNO 3(азеотропная смесь), после чего состав перегоняемой смеси не изменится 1. В промышленности перегонку разбавленных водных растворов азотной кислоты осуществляют в присутствии водоотнимающих веществ (концентрированная серная кислота, фосфорная кислота, концентрированные растворы нитратов и др.). Применение водоотнимающих веществ дает возможность понизить содержание водяных паров над кипящей смесью и увеличить содержание паров азотной кислоты, при конденсации которых получается 98%-ная HNО 3.
Составьте химическую схему получения концентрированной азотной кислоты прямым синтезом. Используя физико-химические основы процесса, обоснуйте выбор технологического режима. Процесс производства разбавленной азотной кислоты складывается из трех стадий: 1) конверсии аммиака с целью получения оксида азота 4NH 3+ 5О 2→ 4NO + 6Н 2О 2) окисления оксида азота до диоксида азота 2NO + О 2→ 2NO 2 3) абсорбции оксидов азота водой 4NO 2+ О 2+ 2Н 2О → 4HNO 3 Суммарная реакция образования азотной кислоты выражается NH 3+ 2О 2→ HNO 3+ Н 2О Агрегаты, работающие по комбинированной схеме, мощностью 45¸50 тыс. Т/год (давление на стадиях конверсии аммиака и абсорбции оксидов азота, соответственно 0,098 и 0,343 МПа), которые были созданы в 60-е годы для получения 45-48% -ой азотной кислоты.
В 70-е годы в Государственном научно-исследовательском и проектном институте азотной промышленности и продуктов органического синтеза были разработаны и внедрены агрегаты УКЛ-7 с единичной мощностью 120 тыс. Т/год, работающие под единым давлением 0,716 МПа и снабженных пусковым электродвигателем. Последующим шагом явилось разработка и внедрение еще более мощных агрегатов АК-72 производства азотной кислоты мощностью 360-380 тыс. Т в год по комбинированной схеме (давление на стадии конверсии аммиака - 0,392 МПа, на стадии абсорбции оксидов азота - 1,079 МПа с той же системой каталитической очистки, что и в агрегатах УКЛ-7). Агрегат АК-72 позволяет получить азотную кислоту концентрацией 58-60% с содержанием оксида азота в выхлопных газах не более 0,005% В основу этих агрегатов положена так называемая, энерготехнологическая схема, в которой используется энергия химических реакций превращения аммиака в азотную кислоту. В технологическую схему внедрена высокотемпературная очистка (каталитическая) хвостовых газов от оксидов азота с использованием природного газа в качестве восстановителя и в сочетании с газовой турбиной для рекуперации энергии.
Подобная система позволила снизить содержание оксидов азота в выхлопных газах до 0,002¸0,005% по сравнению с 0,1¸0,3% в старой комбинированной схеме. Надежность, простота управления, минимальные капитальные затраты и снижение себестоимости кислоты при практически полной очистки выхлопных газов от оксидов азота - главные критерии, на которые опирались проектировщики при создании энерготехнологических агрегатов. Унифицированная комплексная линия производства азотной кислоты АК-72 полностью автономна по энергии. Баланс ее в схеме замыкается за счет установки на одной оси с воздушным компрессором высокотемпературной газовой турбины.
Производство Азотной Кислоты В Промышленности
Это выгодно отличает данную схему от зарубежных, где одновременно с низкотемпературной газовой турбиной дополнительно устанавливается еще паровая, работающая на паре полученном на этой же установке. Позднее линия АК-72 была модернизирована, в неё был введен ряд изменений и, в частности, селективная очистка хвостовым газом аммиаком. Производство неконцентрированной азотной кислоты по схеме АК-72 введено в эксплуатацию в начале 80-х годов. Проектная мощность производства - 380 тыс. Тонн в год азотной кислоты в пересчете на 100% НNО 3при 7920 рабочих часах в год. Среднечасовая производительность агрегата составляет 47,98 тонн. Производство азотной кислоты осуществляется методом каталитического окисления аммиака кислородом воздуха при избыточном давлении - 0.31 МПа и абсорбции образовавшихся окислов азота конденсатом водяного пара или деминерализованной водой при избыточном давлении 1,0-1.14 МПа.
При давлении 0,3-0,4 МПа можно достичь высокой степени конверсии аммиака (до 97%) и расход платины будет составлять не более 0,1-0,12 г/т НNO 3. Агрегат оснащен установкой для каталитического разложения остаточных оксидов азота в выхлопном газе с использованием в качестве восстановителя природного газа с последующей рекуперацией энергии очищенных газов в газовой турбине. Особенностью агрегата АК-72 является применение высокотемпературной каталитической очистки выхлопных газов от оксидов азота с помощью природного газа и подача горячих выхлопных газов в газовую турбину без предварительного охлаждения. При выбранных параметрах технологического процесса количества освобождающейся энергии достаточно для сжатия воздуха и нитрозных газов, если температура выхлопных газов равна 760°С. Предварительный подогрев выхлопных газов перед подачей в реактор каталитической очистки до температуры начала реакции 440-500°С осуществляется в трубчатом подогревателе за счет рекуперации тепла выхлопных газов, расширенных в турбине, и тепла сжигаемого природного газа в топке радиационной части подогревателя. Весь пар, получаемый в котле утилизаторе, выдается на сторону, как побочный продукт. Давление вырабатываемого пара 4,0 МПа и температура 440°С, что позволяет его использовать для выработки электроэнергии.
Охрана окружающей среды в производстве азотной кислоты. Для обеспечения охраны окружающей среды в производстве азотной кислоты по схеме АК-72 осуществляется использование отходов производства, предварительная очистка и подготовка сбросов в канализацию или атмосферу. Используемыми отходами производства являются:. перегретый пар с давлением 2,65 МПа (27 кгс/см2) и температурой не более 305 ºС;. насыщенный пар после паровой турбины ГТТ-12 давлением 0,88 - 0,98 МПа (9-10 кгс/см2), температурой 250 ºС. аммиачная вода, образующаяся в аварийной емкости при нагревании продувок из испарителей аммиака, периодически передается на переработку;.
Получение Азотной Кислоты В Промышленности Уравнение
аммиак газообразный с давлением 0,39 - 0,49 МПа (4-5 кгс/см2) и температурой не более 120 ºС их испарителей, во время пусков агрегатов и из емкости постоянно при выпарке аммиака из поступающих продувок. Передается в заводскую сеть предприятия на аммиачно-холодильную установку;. масло турбинное (отработанное). Периодически, при замене масла в агрегате ГТТ-12 по трубопроводу или контейнером выдается в цех регенерации масел;. отработанный катализатор АПК-2, АПЭК-0,5 отправляется на завод втордрагметаллов.
В газовые выбросы по производству входят:. выбросы вентиляционные от вытяжных вентиляции производственного помещения, лаборатории, комнаты регенерации катализаторных сеток.

Получение Азотной Кислоты В Промышленности
Сброс постоянный;. очищенный выхлопной газ после газовых турбин ГТТ-12. Сброс постоянный через выхлопную трубу высотой 150 м для обеспечения необходимого рассеивания.